由两种化合物互相交换成分,生成另外两种化合物的反应。
复分解反应的定义1
复分解反应,是四大基本反应类型之一,它是由两种化合物互相交换成分生成另外两种化合物的反应,可简记为AB+CD=AD+CB。复分解反应的本质是溶液中的离子结合成难电离的物质(如水)、难溶的物质或挥发性气体,使复分解反应趋于完成。
想要正确地书写有关复分解反应的化学方程式,需要兼顾两个方面,一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生成物中有沉淀析出或有气体放出,或有水生成或难电离的物质生成。
复分解反应的定义
由两种化合物互相交换成分,生成另外两种化合物的.反应,叫做复分解反应。可简记为AB+CD=AD+CB。复分解反应是由两种化合物参与反应,生成物也是两种化合物,所以复分解反应的产物种类数,可以用组合数学的排列组合原理来确定。
排列组合原理指出,产物的种类数为两个反应物中有效原子团的乘积。如硫酸和氢氧化钠反应,生成水和硫酸钠,水的数量为2个氢原子和1个氧原子的乘积,即2x1=2种。又如氯化钙和碳酸反应,生成碳酸钙和盐酸,碳酸钙的种类数为2个钙原子和3个氧原子的乘积,即2x3=6种。
需要注意的是,以上只是复分解反应的一般定义,实际上复分解反应的成立需要在反应物和生成物之间满足一定的条件。例如,反应物需要具有一定的溶解度、反应需要有一定的酸碱中和等因素都会影响复分解反应的成立。
复分解反应的定义2
一、概念
复分解反应是重要的四种基本化学反应类型之一,同时它也是酸、碱、盐相互反应的核心内容。 即:AB+CD=AD+CB 生成物中有沉淀或有气体或有水。这是能够观察到的宏观现象,生成沉淀、气体或水都会使溶液中离子浓度减小,反应沿着正向进行。复分解反应的特点:化合物反应物与生成物均为化合物;相交换,反应物相互交换成分;价不变,反应物,生成物的化合价都不变。
二、实质
从宏观角度来说,反应能否发生是有特定条件的。对生成物而言,两种化合物之间进行成分交换后生成的另外两种化合物中必有水、气体或沉淀;对反应物而言,当反应物中没有酸时,反应物要均可溶于水时反应才能发生。
依据概念和反应条件进行微观探析:复分解反应只是两种化合物之间相互交换离子成分,反应前反应物中各离子是以一定比例共存的,在反应前后各元素化合价不变,离子种类和个数不变,但随反应的持续发生,溶液中自由移动的离子浓度不断减小。
即复分解反应是电解质在溶液中发生的离子间相互反应。当溶液中存在的某些离子能互相结合而使其浓度迅速减小的话,那么离子就向减小离子浓度的方向进行。

三、发生条件
复分解反应共可以分为以下五种类型,实质上,除了对生成物有要求外,复分解反应的发生对反应物也有一定的要求,即当反应物中没有酸时,反应物要均可溶于水,现归纳对比如下:
(1)酸+盐—→新酸+新盐
反应物中酸必须是可溶的,生成物中至少有一种物质是气体或沉淀或水、
如:2HCl+CaCO3=CaCl2+H2O+CO2↑
(2)酸+碱—→盐+水
反应物中至少有一种是可溶的、
如:H2SO4+Cu(OH)2=CuSO4+2H20
(3)盐+盐—→两种新盐
反应物中的'两种盐都是可溶性的,且反应所得的两种盐中至少有一种是难溶的、
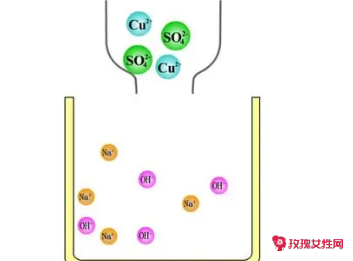
如:Na2SO4+BaCl2=2NaCl+BaSO4↓
(4)盐+碱—→新盐+新碱
反应物一般都要可溶,生成物中至少有一种是沉淀或气体(只有氨盐跟碱反应才能生成气体)、
如:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ; NaOH+NH4Cl=NaCl+NH3↑+H2O
Fe(OH)3与NaCl不发生反应
方法指导:概括上述四种类型的复分解反应能够发生并趋于完成的条件,可分成两方面记忆掌握、一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生成物中有沉淀析出或有气体放出,或有水生成、这两方面必须兼顾,才能正确地书写有关复分解反应的化学方程式、
反应条件:
气体:CaCO3+2HCl=CaCl2+H2O+CO2↑
沉淀:Ca(OH)2+NaCO3=CaCO3↓+NaOH
水:H2SO4+2NaOH=NaSO4+2H2O
复分解反应的注意点:
1、特别要注意的是,碱+非金属氧化物→盐+水的反应不是复分解反应。
因为根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。
如【H2SO4+BaCl2====BaSO4↓+2HCl】这个反应中,硫酸的成分(H+和SO42-)与氯化钡的成分(Cl-和Ba2+)互相交换,形成了硫酸钡和盐酸。
而例如【CO2+Ca(OH)2====CaCO3↓+H2O】反应中二氧化碳的成分并没有与氢氧化钙的成分互相交换,所以这样的反应不是复分解反应。
可以看成CO2溶于水生成H2CO3后,H2CO3再与Ca(OH)2发生复分解反应。
同理,CO2+2NaOH====Na2CO3+H2O和SO2+2NaOH=Na2SO3+H2O之类的反应也不是复分解反应。
2、酸+金属氧化物→盐+水,属于复分解反应。如:CaO+2HCl====CaCl2+H2O
碱+非金属氧化物→盐+水,不属于复分解反应。如:CO2+2NaOH====Na2CO3+H2O
复分解反应的定义3
复分解反应是一种化学反应,指的是一个化合物在一定条件下分解成两个或更多的物质。
具体解释:
在复分解反应中,反应物是一个单一的化合物,而产物是两个或多个不同的化合物或元素。
复分解反应可以通过不同的方式引起,如热分解、电解、光解等。其中,热分解反应是指在高温下,化合物分解为更稳定的产物。电解反应是指在电解过程中,电能被使用来分解化合物。光解反应是指在光照下,化合物分解为产物。
复分解反应可以通过化学方程式来表示。方程式中,反应物位于反应物的一侧,产物位于产物的一侧。化学方程式还显示了反应物和产物之间的摩尔比例关系。
复分解反应的意义:
复分解反应在化学领域中具有重要的意义。首先,它可以用于制备目标物质。通过控制反应条件和选择适当的反应物,可以合成所需的化合物或元素。
其次,复分解反应可以用于研究物质的性质和反应机理。通过观察反应的产物和反应速率,可以深入了解化合物的结构和反应过程。
复分解反应对社会的贡献:
1、药物研发
复分解反应可以用于合成和分解药物。它可以帮助科学家们研究药物的活性成分,并改善其吸收、代谢和降解的.性质。这对于药物的研发和改进具有重要意义,可以提高治疗效果和减少副作用。
2、 能源生产
复分解反应在能源领域也有着重要的应用。例如,水电解反应将水分解成氢气和氧气,氢气可以作为一种清洁燃料使用,不产生碳排放。这种反应有望成为未来能源的可持续替代选择。
3、 环境保护
复分解反应可以用于处理和分解有害物质,有助于环境保护。例如,光解反应可以将有害的有机化合物分解成无害的物质,从而减少对环境和生态系统的污染。
4、 废物处理
复分解反应还可以用于废物处理和回收。通过对废物进行复分解,可以将其转化为有用的物质,减少对自然资源的依赖和环境的负荷。
5、 材料制备
复分解反应在材料科学和工业生产中也起着重要作用。它可以用于合成各种材料,如聚合物、金属合金和纳米材料,为新材料的研发和应用提供基础。